Dieta chetogenica e cancro al fegato: nuove prove mostrano come i grassi cambiano le cellule epatiche
La dieta chetogenica non si limita a sovraccaricare il fegato, ma può cambiare profondamente il comportamento delle cellule epatiche, rendendole più vulnerabili al cancro. È quanto emerge da un nuovo studio condotto da ricercatori del Massachusetts Institute of Technology (MIT), che ha analizzato cosa accade alle cellule del fegato quando sono esposte per periodi prolungati a regimi alimentari ad alto contenuto di grassi.
I risultati, pubblicati sulla rivista scientifica Cell, indicano che, sotto uno stress metabolico continuo, le cellule epatiche mature abbandonano gradualmente le loro funzioni specializzate e tornano a uno stato più primitivo, simile a quello delle cellule staminali.
Questo cambiamento aiuta le cellule a sopravvivere in un ambiente ostile, ma ha un prezzo. “Se le cellule sono costrette a gestire ripetutamente un fattore di stress, come una dieta ricca di grassi, faranno ciò che le aiuta a sopravvivere, con il rischio di una maggiore suscettibilità alla sviluppo di tumori” spiega il professor Alex K. Shalek, direttore dell’Institute for Medical Engineering and Sciences del MIT e autore senior dello studio.
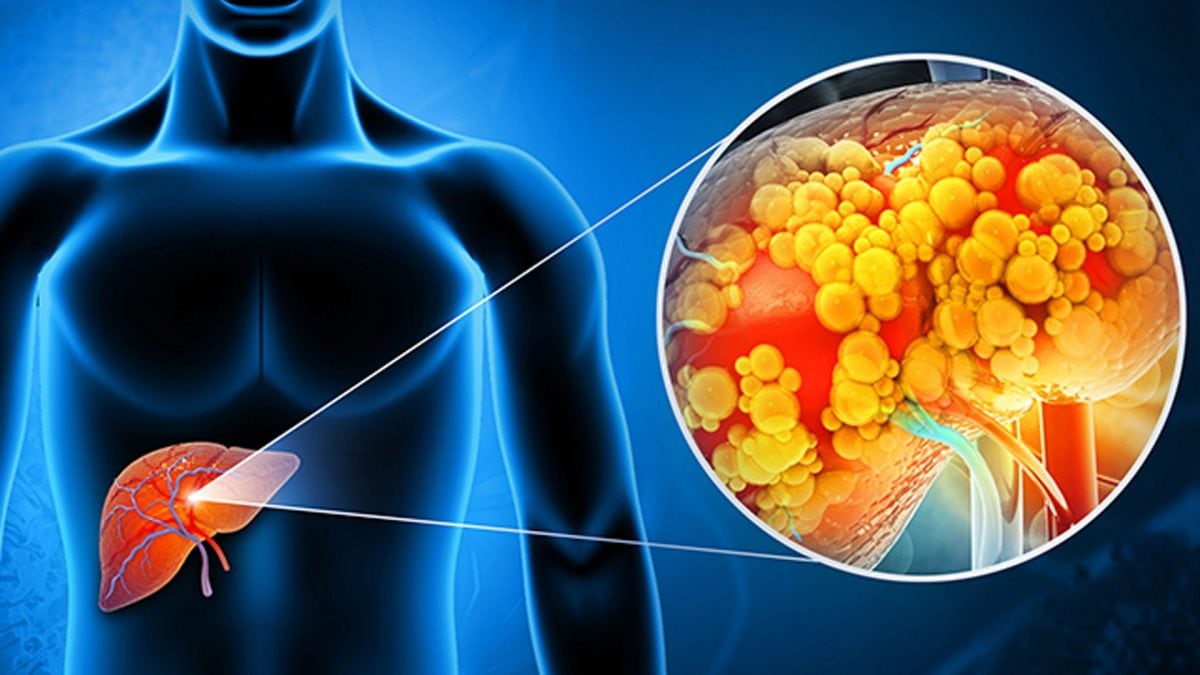
Nel tempo, questa “modalità di sopravvivenza” rende il tessuto epatico meno efficiente e più predisposto alla trasformazione tumorale, contribuendo a chiarire perché condizioni come la steatosi epatica spesso precedano il cancro al fegato.
Il contesto è rilevante anche dal punto di vista della salute pubblica. Secondo l’Organizzazione Mondiale della Sanità, le malattie epatiche e metaboliche rientrano tra le principali patologie croniche non trasmissibili legate a dieta e stili di vita, e rappresentano un fattore chiave di rischio per tumori e mortalità prematura. Comprendere come l’alimentazione modifichi le cellule nel lungo periodo è quindi cruciale per la prevenzione.
Dieta chetogenica e cancro al fegato: cosa mostrano i risultati dello studio
Per capire cosa accade a livello cellulare, i ricercatori hanno utilizzato modelli animali alimentati con una dieta ricca di grassi e hanno analizzato il fegato con tecniche avanzate di sequenziamento dell’RNA a singola cellula. Questo approccio ha permesso di seguire passo dopo passo l’evoluzione delle cellule epatiche, dall’infiammazione iniziale fino allo sviluppo del tumore.
I dati mostrano che gli epatociti, le principali cellule del fegato, attivano geni che favoriscono la sopravvivenza e la proliferazione, riducendo allo stesso tempo l’espressione dei geni necessari alle normali funzioni metaboliche. “È un compromesso – osserva il dottor Constantine Tzouanas, primo autore dello studio – . Le cellule danno priorità a ciò che le mantiene in vita in un ambiente stressante, a scapito di ciò che serve al tessuto nel suo insieme”.
Alla fine dell’esperimento, quasi tutti i topi sottoposti a una dieta ricca di grassi avevano sviluppato un cancro al fegato. Secondo i ricercatori, questo processo negli esseri umani potrebbe richiedere decenni, ed essere influenzato da altri fattori di rischio, come il consumo di alcol o le infezioni virali.
Il significato della scoperta: perché la vulnerabilità aumenta nel tempo
Lo studio aiuta a chiarire perché le cellule epatiche “immature” risultino particolarmente pericolose. Quando perdono la loro identità specializzata, sono già biologicamente predisposte a diventare tumorali se si verifica una mutazione dannosa.
“Queste cellule hanno già attivato molti dei geni necessari alla crescita incontrollata – spiega Tzouanas – . Hanno abbandonato l’identità matura che normalmente ne limita la proliferazione. Quando arriva la mutazione sbagliata, sono pronte a partire con un vantaggio”.
Un altro aspetto rilevante riguarda le possibili implicazioni future. I ricercatori hanno identificato diversi fattori di trascrizione che regolano questo ritorno a uno stato cellulare immaturo, alcuni dei quali sono già oggetto di studi farmacologici per il trattamento delle forme più gravi di steatosi epatica. In campioni di fegato umano, gli stessi schemi genetici osservati nei modelli animali risultano associati a una sopravvivenza più breve nei pazienti.
“Ora abbiamo nuovi bersagli molecolari e una comprensione più profonda dei meccanismi biologici in gioco – conclude Shalek – . Questo potrebbe aprire la strada a strategie più efficaci per intervenire prima che il danno al fegato evolva in cancro”.